Назначение аккумулятора в автомобиле
Автомобильный аккумулятор принято обозначать аббревиатурой АКБ, что значит аккумуляторная кислотная батарея. Не все батареи относятся к этому типу, но в автомобилях наиболее распространены именно они.

Автомобильный аккумулятор
Аккумулятор является важным компонентом в работе любого транспортного средства. Он выполняет следующие основные функции:
- Подача электроэнергии на стартер для запуска двигателя. Аккумулятор способен в течение 30 секунд подавать пусковой ток или ток холодной прокрутки на стартер, который, в свою очередь, запускает двигатель.
- Питание бортовой сети в случае недостаточной мощности (производительности) генератора.
- Автономное питание бортовой сети автомобиля.
Каждый аккумулятор имеет определенную емкость и заряд. При работе двигателя всю нагрузку на электропитание берет на себя генератор. Он же заряжает аккумулятор во время движения. Если мощности не хватает, подключается батарея. Определенное время АКБ может обеспечить автономное питание.
Располагается АКБ, как правило, в подкапотном пространстве автомобиля или закреплен на раме в случае крупного грузового транспорта. Это связано с тем, что кислота, находящаяся внутри, очень агрессивна и опасна для здоровья. Она может просочиться через корпус или выделиться в виде газа
С аккумулятором следует обращаться осторожно
Более безопасны необслуживаемые АКБ, внутри которых нет жидкого электролита. Такие батареи практически не выделяют вредных паров и их можно использовать где угодно. Среди альтернативных мест размещения аккумулятора можно выделить багажное отделение и под сиденьем водителя.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее. Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Самодельный простой гальванический элемент. Зарядка мобильного телефона без электросети. | ДелайСам.Ру
Те, кто на даче не имеют электричества, наверняка испытывают определенные неудобства в самых элементарных вещах. Ну ладно там, нет холодильника или телевизора… Но ведь порой даже мобильный телефон подзарядить нет возможности. Запасных аккумуляторов — не напасешься и не навозишься.
Между тем, существует довольно простой способ получить электрический ток достаточный для работы простейших электронных устройств прямо на месте и без больших затрат.
Да, лампочку к такому источнику не подключить, но обеспечить электропитанием небольшой радиоприемник или подзарядить мобильник ему вполне по силам. Такой же источник сможет зарядить небольшие аккумуляторы и в походе, пока туристы спят или отдыхают.
И что особенно ценно, данный источник стоит буквально копейки, работает независимо ни от каких погодных условий и не имеет вообще никаких подвижных частей.
Принцип работы данного источника тока основан на том, что некоторые металлы образуют между собой т.н. гальванические пары. Т.е.
при их соприкосновении образуется простейший гальванический элемент, вырабатывающий электрический ток. Например, по этой причине нельзя соединять напрямую провода из меди и алюминия.
Если два электрода из таких металлов поместить в электролит, они начнут вырабатывать электрический ток. Почему же не использовать этот эффект для того, что бы решить хотя бы одну проблему — с той же зарядкой мобильного телефона в условиях отсутствия электросети.
При устройстве такого простейшего элемента можно использовать в качестве электродов любые медные и железные отрезки проволоки, а лучше — пластины. Пластины дадут бОльший ток. А качестве электролита подойдет сырая земля (грунт), которую лучше пропитать солевым раствором.
Что бы не портить землю на своем участке, лучше насыпать землю в ведра (можно и дырявые) или даже в полиэтиленовые пакеты.
Разумеется, напряжение такого элемента невелико — 0,5-1 вольт максимум. А ток, который он вырабатывает 20-50 мА. Но что нам мешает сделать несколько таких элементов и соединить их последовательно! Таким образом мы достигнем необходимого напряжения, достаточного для зарядки аккумулятора мобильного телефона или другого устройства.
Разумеется, такой элемент примитивен, имеет невысокий КПД. Но! Во-первых, он крайне дешев и делается действительно из материалов, которые валяются под ногами — (проволока, обрезки труб, пластины металла).
Во-вторых, он не требует никаких телодвижений с вашей стороны после его изготовления. Он необслуживаемый! Один раз сделал — пользуйся весь сезон. Ну разве что поливай периодически, поддерживая влажности грунта.
В третьих — сделать его по силам даже школьнику младших классов.
Такими элементами пользовались еще на заре электроники, когда батареи были очень дефицитны и дороги. Теперь же с появлением весьма экономичных и низковольтных электронных приборов массового пользования они возможно кому то снова смогут принести пользу.
К. Тимошенко
Понятие аккумулятор и его устройство
В общем понимании этого слова в технике под термином «Аккумулятор» подразумевается устройство, позволяющие при разных условиях эксплуатации накапливать определенный вид энергии, либо же — расходовать ее для человеческих нужд.
Применимы в тех ситуациях, когда необходимо собрать энергию за определенное время, после чего использовать ее для совершения больших трудоемких процессов. Так — гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по такому же принципу: когда вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а после отдают его подключенным приборам для совершения дальнейшей работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
В процессе работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
На рисунке ниже изображена схема устройства аккумулятора. Изображен тот вид, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
Устройство аккумулятора
Принцип работы сухого элемента, батарейки
Сухой элемент использует активную пасту в качестве электролита, влажности которой достаточно только для движения тока. В отличие от влажного элемента, сухой элемент может работать в любом положении без протечек, так как не содержит свободной жидкости, что делает его подходящим для портативной электроники.
Для сравнения, первые влажные элементы представляли собой хрупкие стеклянные контейнеры со свинцовыми стержнями, свисающими с открытой верхушки и требующими тщательного ухода во избежание утечек. Свинцово-кислые батареи не смогли дать той безопасности и портативности сухих элементов до момента создания гелевых батареи.
Влажные элементы продолжали использовать для высокозатратных отраслей, к примеру – старт двигателей внутреннего сгорания, так как ухудшение тока в электролите приводит к уменьшению возможностей тока.
Распространенным примером сухого элемента является марганцево-цинковый элемент, иногда называемый сухим Элементом Лекланше, стандартное напряжение которого составляет 1,5 В, как и у щелочных элементов (так как у них используется то же сочетание цинка и оксида марганца (IV)).
В состав стандартного сухого элемента входит цинковый анод, обычно – в виде цилиндрического бака, и угольный катод в виде центрального резервуара. Электролитом служит хлорид аммония в виде активной пасты, расположенной сразу после цинкового анода.
Оставшееся между электролитом и угольным катодом пространство занято вторым видом активной пасты, состоящей из хлорида аммония и оксида марганца (IV), где последний выступает в роли деполяризатора. В некоторых конструкциях оксид марганца (IV) заменяется хлоридом цинка.
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
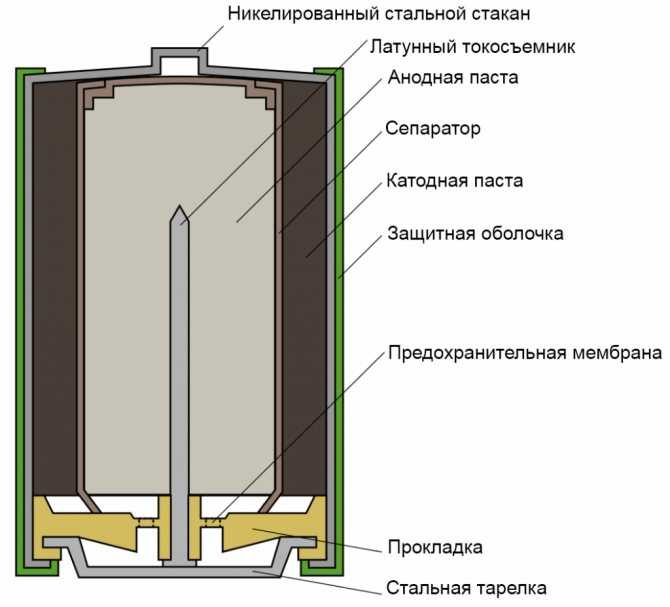
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
- Первый слой — это катод, представляющий собой смесь оксида марганца (MnO₂) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
- Затем идет сепаратор — слой пористого материала, который образует барьер, предотвращающий прямой контакт анодного и катодного материалов друг с другом. В процессе производства на сепаратор распыляется щелочной электролит — гидроксид калия.
- С другой стороны барьера находится анод, который представляет собой пасту, изготовленную из цинкового порошка (Zn), а также желирующего агента. Желирующий агент поддерживает цинк во взвешенном состоянии, чтобы он не накапливался в одном месте.
Материалы АКБ
Пластины
На данный момент наиболее качественные батареи потерпели небольшие изменения. И связаны эти изменения с материалом пластин. Теперь пластины делают не из чистого свинца, а из его сплава с серебром. При этом удалось снизить массу батареи на треть, а срок её службы увеличить на 20 %.
Кроме этого, изменилась сама технология их изготовления. Если первые пластины производились путём их литья, то сегодня их делают из тонкого свинцового листа, путём штамповки. Такой метод дешевле и при этом пластины получаются прочнее и тоньше.
Сепараторы
Одной из причин выхода АКБ из строя является короткое замыкание положительных и отрицательных пластин.
Когда из пластин осыпается активная зона внизу банок происходит замыкание. Чтобы этого не случилось на помощь приходят сепараторы, которые делают в виде конвертов, запаянных снизу, под пластинами. Таким образом, когда активная зона осыпается она остаётся внутри конверта и не замыкает.
Литий-ионные аккумуляторы
Эти батареи получили широкое распостранение благодаря мобильным телефонам и иным гаджетам. Сегодня же, существуют разработки и для автомобилей. Однако, невзирая на все свои достоинства, в автотехнике данный вид АКБ не прижился из-за ряда принципиальных недостатков.
Литий-ионные аккумуляторы
- Они резко теряют свою мощность из-за низкой температуры.
- Для зарядки таких батарей требуется строгое соответствие зарядному току, а это требует переделки электронной части генераторов.
- И самое главное, данные АКБ имеют стоимость в 15 раз дороже обычного кислотного аккумулятора.
Как устроен элемент питания
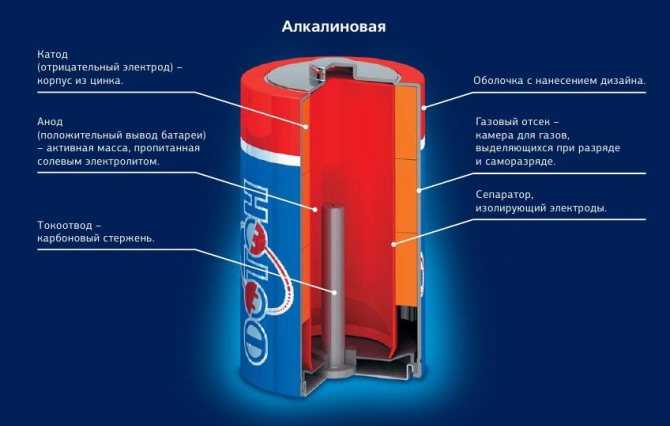
Конструкция алкалиновых батареек предусматривает строение изделия как будто наизнанку, по сравнению с солевыми аккумуляторами:
- Внутри элемента содержится цинковая паста. В ней цинк находится в виде порошка, что увеличивает площадь его взаимодействия, от этого ёмкость аккумулятора выше, нежели у солевых аналогов.
- Цинк, загущенный специальным гелем, вырабатывает отрицательный потенциал, его снимает стержень из латуни.
- Диоксид марганца, смешанный с углеродной составляющей (графит, зола, сажа), отделяется от цинка с загустителем (анода) специальным сепаратором.
- Положительный вывод энергии выполнен в виде стального стакана с покрытием из никеля.
- Отрицательный вывод изготовлен из стальной тарелки.
- Оболочка изолирована от стакана. Это предупреждает возникновение замыкания. Ведь оба элемента расположены в одном отделении изделия.
- Также в щелочном элементе питания присутствует прокладка. Она берет на себя давление газов. Стоит отметить, что их выработка незначительна. Если сравнивать солевую и щелочную батарейку, то у второй газообразование снижено на 80%.
- Для защиты от взрыва данных элементов питания в конструкции предусмотрена камера для сбора газов и мембрана. Если давление внутри батареи очень велико, мембрана лопается, и происходит утечка электролитов.
Как делают батарейки?
Производство батарей начинается с нарезки пластинок из стали в овальные детали. Дальше выполняется сворачивание в металлическую трубочку. Которая затем будет именоваться корпусом. В него помещают химические составляющие, такие как графит, серебряный катализатор, диоксид марганца, сульфат бария, цинк, загуститель, гидрооксид калия. Устройство батарейки не всегда бывает простым.
Дальше пресс скатывает химикаты катода в гранулы. После этого на корпус наноситься бороздка для того, чтобы упростить запайку. Затем на отрицательный полюс наноситься герметик. Параллельно с этим на другом станке идет нарезка перфорированной бумаги. Производиться нанос клея около минусового полюса. Пока корпус передвигается по конвейеру клей высыхает.
Затем производиться впрыскивание гидрооксида калия или электролита. Далее в полость анода впрыскивается цинковый гелий. Цинк придает гелию серебристо белый цвет. Сварочный станок приваривает 4-и сантиметровых гвоздя к крышке батареи. Там будет скапливаться заряд прежде чем разрядиться. После происходит закрытие отрицательного полюса. Затем все края загибаются, и энергетический элемент становиться похожим сам на себя.
Специальный электронный станок проверяет каждый элемент питания на брак и наличие заряда в 1,5 вольт. Дальше остается сделать контрольный штрих приклеить наклейку. Как только это будет сделано каждому источнику питания предстоит пройти через печь. Температура в подобном устройстве 198 градусов, и они будут там находиться всего 3 секунды. Это нужно для того чтобы наклейка хорошо закрепилась.
Что такое батарейка
Обыкновенная батарейка представляет собой электрический источник питания на основе химических реакций. При взаимодействии двух металлических электродов в жидком или твердом электролите происходит выработка энергии в результате взаимодействия элементов. Первая батарейка была изобретена более 2000 лет тому назад, при реакции меди и железа в уксусе вырабатывалось напряжение 1 В.
Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
- АА- пальчиковая;
- ААА- мизинчиковая;
- АААА;
- С- дюймовочка;
- D- бочка;
- квадратная;
- РР3- крона;
- Источники питания миниатюрных размеров.
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
- солевые;
- щелочные;
- ртутные;
- серебряные;
- литиевые.
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Состав батарейки такого вида отличается от своих аналогов применяемым электролитом, в них используется активная щелочь гидроксид калия KOH. Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Литиевые
Данные элементы питания постепенно вытесняют все аналоги. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Устройство батарейки
Рассмотрим, как устроена батарейка на примере щелочного элемента в разрезе. В качестве материала для отрицательного электрода применяется цинк, он пропитывается щелочным электролитом. Вывод анода на корпус изготавливается в виде стальной тарелки. Положительный электрод производят из никелированной стали.
Для того, чтобы не возникало коротких замыканий необходимо изолировать оболочку. Специальная прокладка удерживает газы, которые образуются в ходе химических реакций, так как их количество незначительно, камера для сбора выполняется малых размеров. В конструкции присутствует предохранительная мембрана, она защищает батарейку от возникновения короткого замыкания. Мембрана прорывается, и излишний электролит вытекает наружу.
Любой химический источник питания имеет в своей конструкции положительно и отрицательно заряженные электроды, а также активный электролит. Заряженные частицы электроны перемещаются от минуса к плюсу при подключении нагрузки. Катод выполняет восстановительную функцию, напитываясь зарядом от анода. Жидкий или твердый электролит выполняет функцию проводника для заряженных частиц.
Технология
От того, какие физические процессы лежат в основе генерирования электрического тока, зависит много параметров: чувствительность к условиям окружающей среды, скорость заряда, наличие «эффекта памяти» и другое.
Эффект памяти — это особенность, в результате которой аккумуляторы «запоминают» режим работы, если их разряжать не полностью перед следующей зарядкой. Это приводит к падению ёмкости, так как при последующих циклах батарея будет отдавать ток лишь до зафиксированного химическими элементами предела. Что избежать эффекта памяти, нужно полностью разряжать аккумулятор перед восстановлением.
Никель-кадмиевые
Эти аккумуляторные батарейки появились одними из первых и долгое время им не было альтернативы. Несмотря на появления других, более совершенных систем, они сохраняют свои позиции в устройствах, где нужно надёжное бесперебойное питание под высокой нагрузкой.
Причиной тому — ряд преимуществ:
- Возможность работы под высокой нагрузкой.
- Допускается заряд сильным током за короткое время.
- Термостойкость — сами батареи почти не разогреваются при заряде благодаря малому сопротивлению.
- Возможность хранения в разряженном состоянии.
- Невосприимчивость к низким температурам.
Среди недостатков отмечается:
- Вредное воздействие на окружающую среду.
- Дорогая безопасная утилизация.
- Эффект памяти.
- Внушительный саморазряд при простое.
- Невозможность использования в буферном режиме.
Вытеснение никель-кадмиевых батарей наблюдается в развитых странах, где ужесточаются экологические стандарты.
Мнение эксперта Торсунов Павел Максимович
В бытовом использовании никель-кадмиевые аккумуляторы чаще всего применяются в фото- и видеотехнике, а также в радиоуправляемых моделях.
Никель-металлогидридные
Возникли как попытка избавиться от двух основных негативных параметров никель-кадмиевых батарей — эффекта памяти и вредного воздействия на окружающую среду. Удалось добиться полной экологической безопасности этих элементов питания. Они практически не подвержены эффекту памяти — их можно дозаряжать в любом состоянии. Большим плюсом является также повышение ёмкости при схожих параметрах — примерно на 20%. Однако не обошлось и без минусов: из-за особенностей технологии срок службы никель-металлгидридных батарей ниже, чем конкурентных вариантов, их саморазряд больше, чем у конкурентов.
В 2005 году были презентованы аккумуляторы серии Eneloop — первые LSD Ni-Mh. Они соединили в себе преимущества кадмиевых и старых гидридных батарей. Оставленные храниться на длительное время, эти инновационные аккумуляторы теряют значительно меньший процент своей ёмкости. Да и к температурным условиям они менее требовательны.
Если нужно хранить Ni-Mh аккумуляторы, то их нужно полностью зарядить и отправить в холодильник, желательно в герметичном zip-пакете против воздействия влажности.
Литий-ионные
Данный тип аккумуляторов чрезвычайно распространён в мобильных телефонах, плеерах, смарт-часах и других гаджетах. Однако производитель нередко выпускает их и в форм-акторе пальчиковых батареек.
Причины популярности литий-ионной технологии:
- Крайне низкий ток саморазряда (неработающее устройство сохраняет заряд месяцами).
- Большая ёмкость при небольших размерах.
- Возможность работы с разными токами.
- Выходное напряжение не падает, а сохраняется вплоть до полного разряда.
Главный минус литий-ионных батарей — это чувствительность к изменению токов, а также к полному разряду. Потому лучше всего данный тип функционирует в связке с электронными контроллерами и блокираторами, которые выравнивают входное напряжение, а также автоматически отключают аккумулятор при достижении определённых показателей.
Мнение эксперта Торсунов Павел Максимович
Литий-ионные аккумуляторы «боятся» холода, активно теряя заряд. Также они могут загореться, поэтому с ними стоит быть осторожным.
Устройство батарейки
Конструкционные особенности батареек связаны, прежде всего, с их размерами и формой.
Цилиндрической
Цилиндрическая батарейка имеет вытянутый корпус. Оболочка в таких элементах чаще состоит из металла. Эта часть надёжно изолирована от внутренних деталей.
Сразу после диэлектрической оболочки следует тонкий стакан из токопроводящего металла (цинка в солевых батареях). Этот элемент соединяется с отрицательным выводом батарейки.
В середине цилиндрического элемента питания располагается графитовый стрежень, который является положительным выводом. В контактной части на эту деталь надевается металлический колпачок для защиты от механических повреждений.
В пространстве между центральным стержнем и отрицательной оболочкой находится электролит и деполяризующая смесь.
Круглой (миниатюрной)
Кнопочная батарея является незаменимым элементом питания в наручных часах и других миниатюрных электрических устройствах. Срок службы таких батареек, как правило, выше чем у пальчиковых, но причина длительной работы связана, прежде всего, с небольшим электропотреблением устройств, в которые устанавливается данный элемент.
Состоит такая батарейка из положительного и отрицательного полюсов, между которыми находятся вещества, вступающие в химическую реакцию при подключении к источнику тока потребителей.
Разноимённые контакты в таких изделиях надёжно изолированы друг от друга диэлектрическим материалом. Наиболее часто кнопочные батареи производят по воздушно-цинковой технологии.
Крона
Крона отличается от других батареек тем, что внутри элемента находится 6 небольших источников питания по 1,5 Вольт. Принцип работы каждого отдельного изделия не отличается от пальчиковых или кнопочных батарей.
Корпус батарейки «Крона» изготавливается из металла, но также может использоваться прочный пластик. Отдельные элементы располагаются сверху вниз и подключаются последовательно. Положительный и отрицательный выводы находятся на одной из плоскостей, которая изготавливается из диэлектрика.
История батарейки — гальванического элемента
Свое название гальванические элементы получили по имени итальянского врача и анатома Луиджи Гальвани (1737 — 1798). Проводя опыты с лягушками, Гальвани заметил, что свежепрепарированная лягушачья лапка, подвешенная на медном крючке к железному стержню, сокращается, когда к ней прикасались железом. Наблюдения были истолкованы им как проявление «животного электричества».
Объясняя это явление позже итальянский физик Александро Вольта установил, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. Сама лягушачья лапка играла роль чувствительного прибора.
Александро Вольта создал первый источник тока («Вольтов столб»), который можно было использовать на практике. Этот источник состоял из медных и цинковых пластин, между которыми были проложены кружочки ткани, пропитанные раствором щелочи.
Александро Вольта предложил разделить все проводники на два рода:
- Сухие — металлы и уголь.
- Влажные — электролиты(влажные).
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |


































